【高校化学基礎まとめ】分子の結合
共有結合
共有結合 2個の原子がそれぞれ1個の電子を出し合い,それらを共有してつくられる結合を共有結合という。
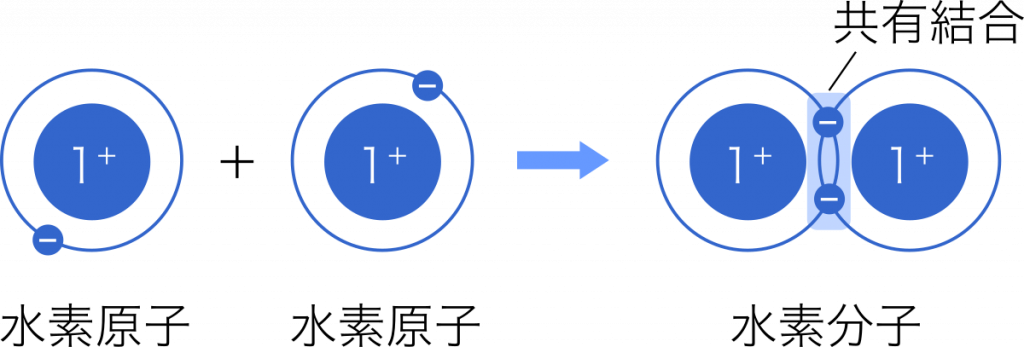
共有結合とイオン結合の違い
たとえば,塩化水素 HCl は共有結合である。しかしながら,HCl は水溶液中で $\text{H}^+$ と $\text{Cl}^-$ のイオンに電離するので,イオン結合であるように見えるかもしれない。
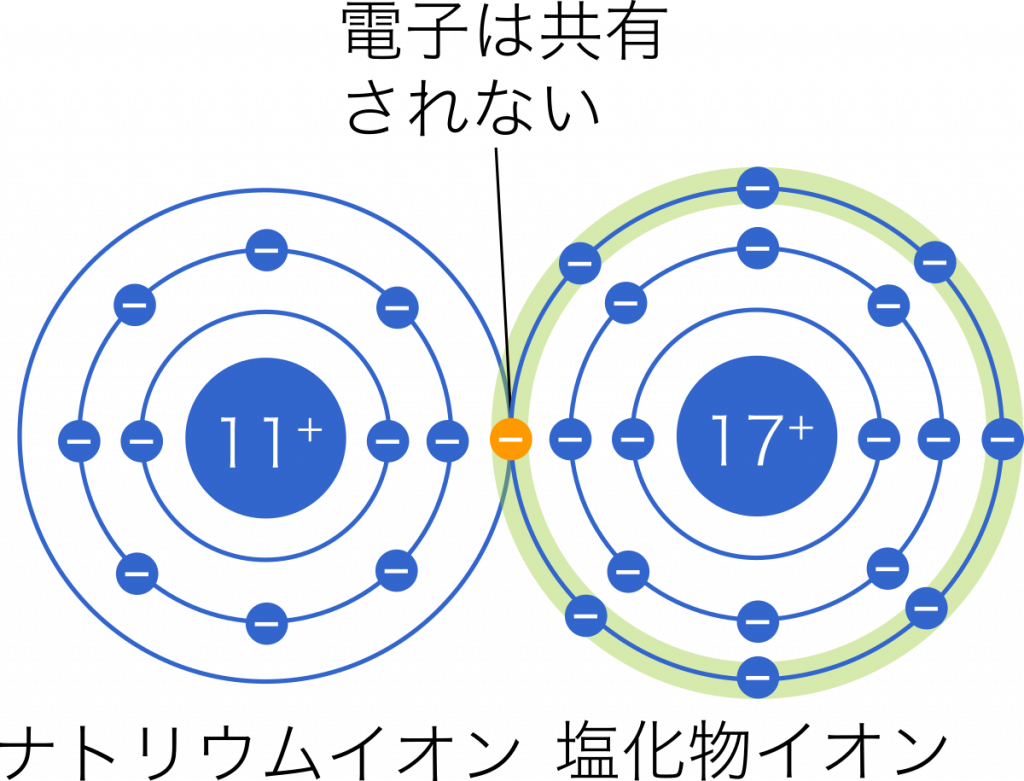
イオン結合は,2種類の原子において電気陰性度が大きく異なることによって起こる結合である。このとき,受け渡される電子は,電気陰性度の大きな原子の側に強く引き付けられている。たとえば,イオン結合である塩化ナトリウム NaCl では,$\text{Cl}^-$ が持つ電子を $\text{Na}^+$ が受け取っているようにイメージするかもしれないが,実際には陰イオンの電子はお互いに共有されているわけではなく,あくまで $\text{Cl}^-$ の周りだけを飛び回っている状態をイメージするとよいだろう。
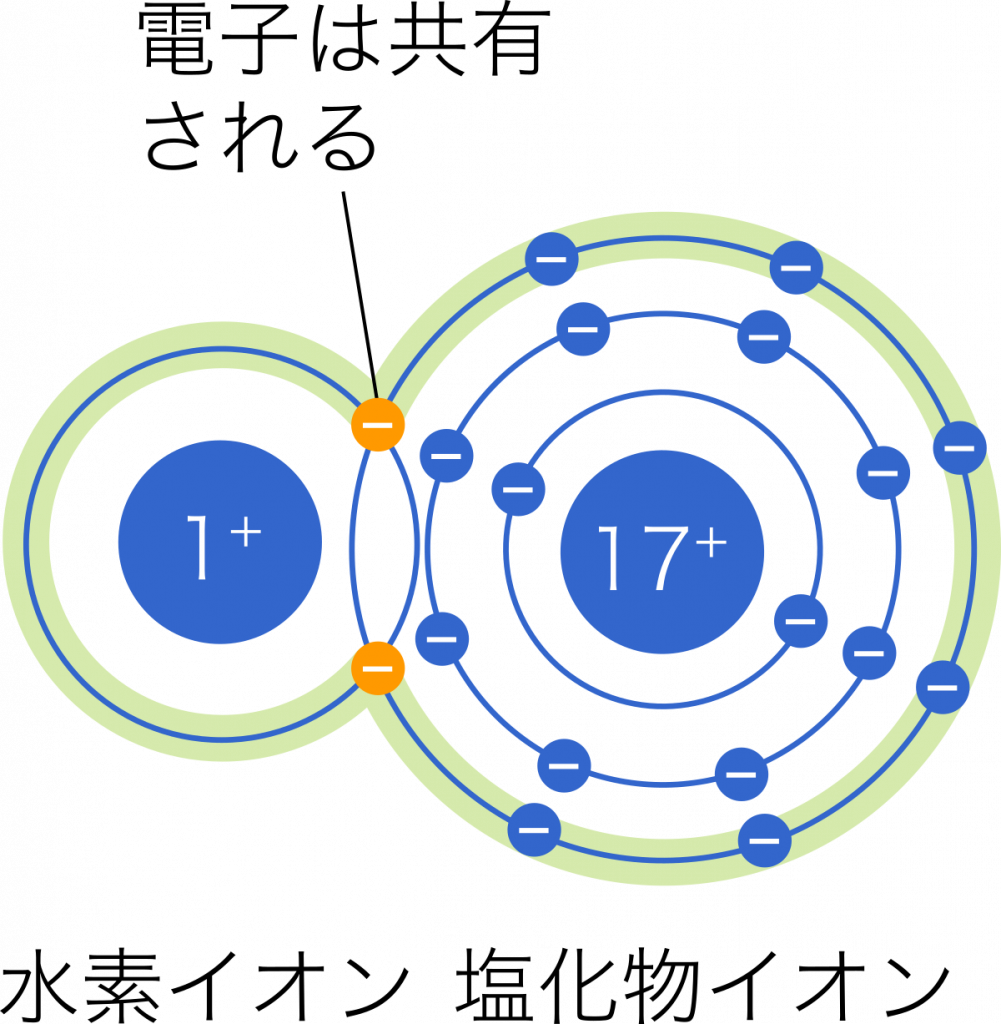
一方で,共有結合では電気陰性度の差は無いか小さなものであるため,共有された電子はどちらの原子も周りも飛び回っている状態としてイメージできる。塩化水素では実際には共有電子はわずかに塩素原子の方に偏っている。
厳密には,共有結合はある程度イオン結合でもあり,その逆もしかりである。したがって,共有結合とイオン結合の明確なさかい目は無いが,共有結合の度合が高いものがそう呼ばれている。
見分け方として,次のように考えてもよい。希ガス以外の非金属元素の原子どうしの結合が共有結合である。一方,金属元素の原子と非金属元素の原子どうしの結合がイオン結合である。
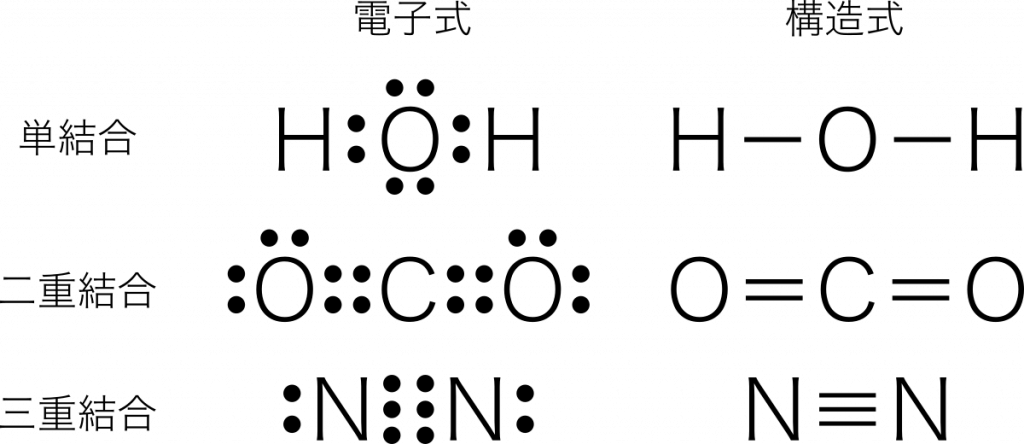
単結合
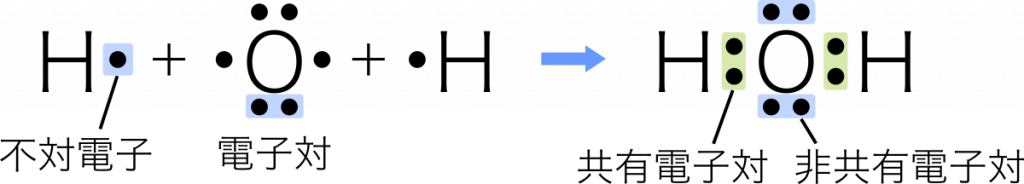
単結合 1組の共有電子対による共有結合を単結合という。例:水 $\text{H}_2\text{O}$
二重結合 2組の共有電子対による共有結合を二重結合という。例:二酸化炭素 $\text{CO}_2$
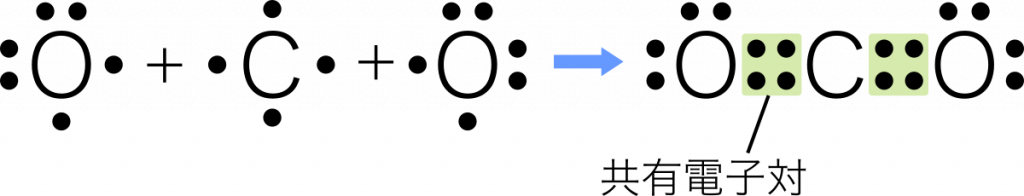
三重結合 3組の共有電子対による共有結合を三重結合という。例:窒素 $\text{N}_2$

電子式と構造式
電子式の共有結合を棒線に置き換えると構造式になる。また,この棒線のことを価標という。
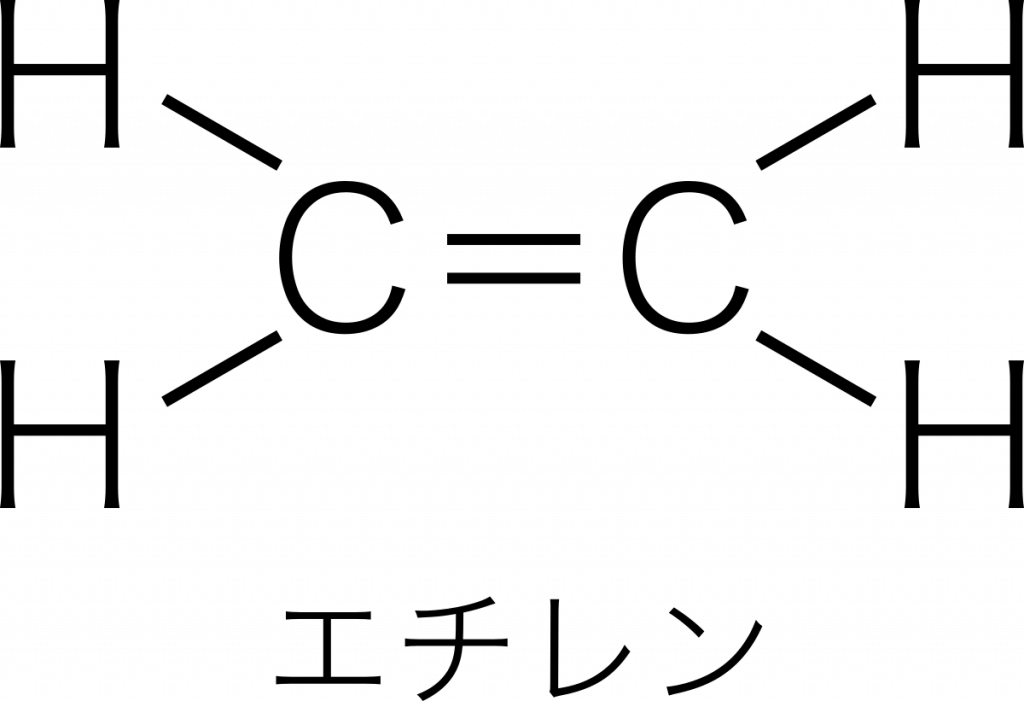
1つの原子からのびる棒線の数を原子価という。例えば,炭素原子が水素原子と結合してエチレン $\text{C}_2\text{H}_4$ をつくるとき,1個の炭素原子から4本の棒がのびているので,炭素の原子価は4である。
同様に,水 $\text{H}_2\text{O}$ の構造式を考えれば,水素原子 H の原子価は 1,酸素原子 O の原子価は 2,また窒素 $\text{N}_2$ の構造式から,窒素原子 N の原子価は 3 であることが分かる。
分子式,イオン式,組成式,構造式などをまとめて化学式という。
電気陰性度・分子の極性
電気陰性度 原子が共有電子を引き寄せる強さを相対的な数値で表したものを電気陰性度という。周期表の右上にある元素ほど電気陰性度が強くなる(希ガスを除く)。
無極性分子 水素分子 HーH は同じ原子の共有結合であり,電気陰性度が同じである。このとき,共有電子は偏ることなく均等に分布する。このように極性をもたない分子を無極性分子という。
共有結合する原子の種類が異なっていても,二酸化炭素 O=C=O ,メタン 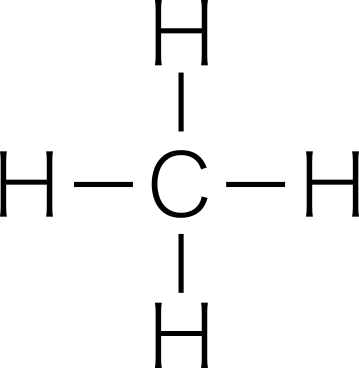 などは分子全体としては無極性分子である。
などは分子全体としては無極性分子である。
極性分子 塩化水素分子 HーCl は異なる種類の原子どうしの共有結合であり,電気陰性度が異なる。このとき,共有電子対はわずかに塩素原子の方へ引き寄せられる。このように電子の分布に偏りがあり,極性をもつ分子を極性分子という。塩素原子はわずかに負の電荷を帯び,水素原子はわずかに正の電荷を帯びる。
二酸化炭素と水の極性
二酸化炭素 O=C=O と,水 HーOーH は構造式の形が似ているため極性を混同しやすい。
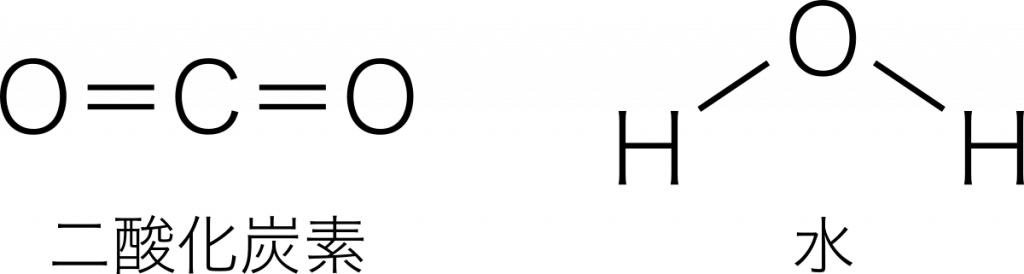
二酸化炭素は原子が直線に並んでいるため,分子全体では極性をもたない。一方,水は折れ線形をいるため,電子の分布に偏りが生じる。したがって,水は極性分子である。
同様に正四面体形であるメタン $\text{CH}_4$ と,三角錐形であるアンモニア $\text{NH}_3$ も混同しやすいので注意が必要である。メタンは無極性分子,アンモニアは極性分子である。
共有結合の結晶
ダイヤモンド 炭素の同素体の一つで,共有結合による正四面体の構造を繰り返した立体構造をとる。無色・透明で非常に硬く,電気を通さない。
黒鉛 炭素の同素体の一つで,共有結合による正六角形の構造が繰り返された平面構造をとる。光沢のある黒色で軟らかく,電気をよく通す。平面方向に沿って薄くはがれやすい。
ケイ素 シリコンと呼ばれる。共有結合による正四面体の構造を繰り返した立体構造をとる。灰色で融点が高い。半導体としての性質を持つ。
二酸化ケイ素 $\text{SiO}_2$ 硬くて融点が高く,水に溶けにくい。石英,けい砂として存在する。ガラスや陶磁器などの原料。共有結合による四面体の構造を繰り返した立体構造をとる。
金属結合
金属結合 自由電子による金属原子の間の結合を金属結合という。また,金属結合によって生じる結晶を金属結晶という。
自由電子 金属結晶内では価電子が自由に動き回ることができる。これを自由電子という。
金属は,金属光沢をもち,電気伝導性,熱伝導性が大きい。また,延性(線上に引き延ばすことができる)や展性(薄く広げることができる)をもつ。
水素結合
水素結合 水素原子を仲立ちとして,隣接する分子どうしが引き合う結合を水素結合という。
フッ化水素分子 HーF はたがいの電気陰性度の差が大きく,H は強く正に帯電し,F は強く負に帯電する。このとき,H ととなり合う分子の F が引き合うことによって分子どうしが引き合う。

水分子 HーOーH では,H は強く正に帯電し,O は強く負に帯電している。同様に,H と O が引き合う。
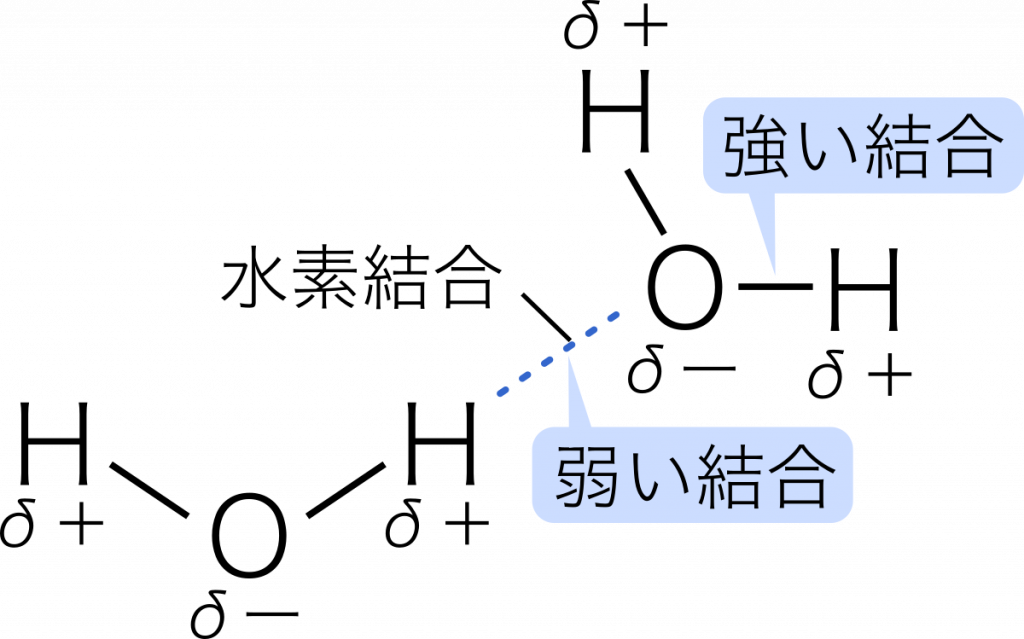
水素結合は極性分子どうしにはたらくクーロン力より強く,共有結合やイオン結合に比べかなり弱い。
ファンデルワールス力 水素結合以外の分子間にはたらく引力をファンデルワールス力という。
すべての分子間にはたらく引力を分散力という。無極性分子の間にはたらく引力は分散力である。また,極性分子間にはたらく静電気的な引力をクーロン力という(極性分子間にも分散力は存在している)。分散力とクーロン力をまとめてファンデルワールス力という。
水素結合とファンデルワールス力をまとめて分子間力という。分子間力の大きな物質ほどその液体の融点は高くなる。たとえば,水素結合によって結びついているアンモニア $\text{NH}_3$,フッ化水素 $\text{HF}$,水 $\text{H}_2\text{O}$ は他の同族の水素化合物に比べ,沸点が高い。
分子結晶
分子結晶 分子どうしが分子間力で引き合い,規則正しく配列した結晶と分子結晶という。ドライアイス(二酸化炭素),ヨウ素,ナフタレンなど。融点が低く,軟らかい。
付加重合と縮合重合
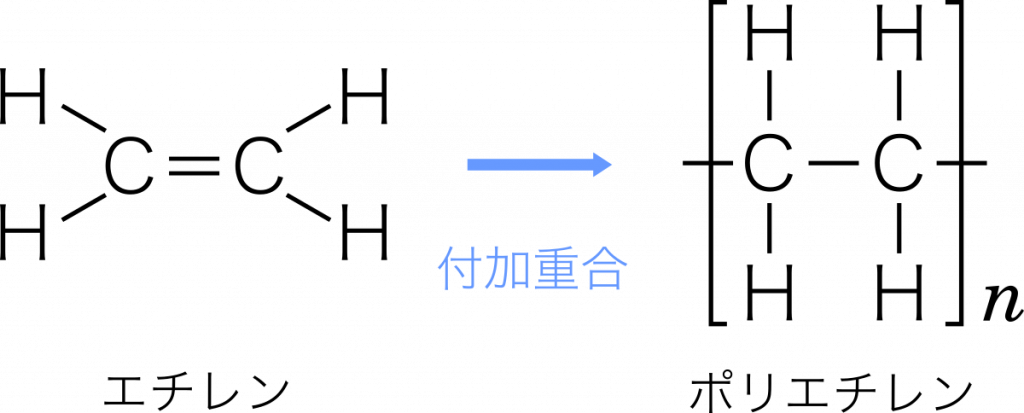
ポリエチレン エチレンが付加重合(二重結合が次々と開いて別のエチレンと単結合する)して高分子化合物となったもの。このとき,エチレンを単量体といい,単量体が繰り返し共有結合でつながった構造を重合体という。ポリエチレンは容器などに使われる。
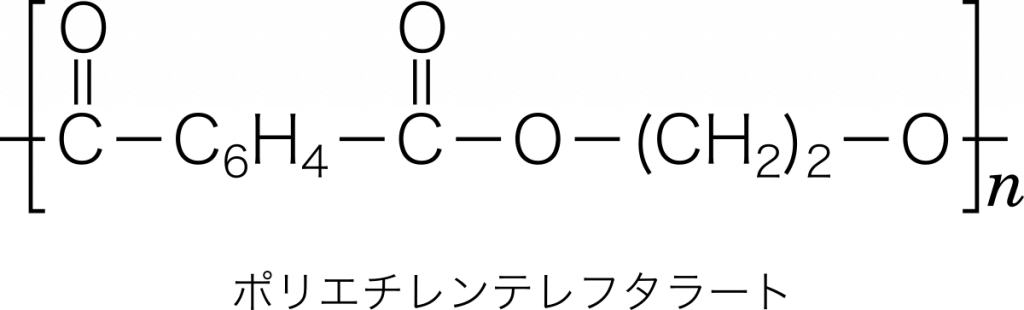
ポリエチレンテレフタレート(PET) テレフタル酸 $\text{C}_6\text{H}_4(\text{COOH})_2$ とエチレングリコール $\text{C}_2\text{H}_4(\text{OH})_2$ から水分子 $\text{H}_2\text{O}$ がとれながら,繰り返し共有結合したもの。このように水などの簡単な分子がとれながら共有結合する重合を縮合重合という。
SNSでシェア