【高校化学基礎まとめ】原子
原子
原子 原子の中心には原子核が存在し,正の電荷をもつ陽子と,電荷をもたない中性子からできている。また,原子核のまわりに負の電荷をもつ電子が存在している。原子に含まれる陽子と電子の数は等しく,全体として電気的に中性である。
元素記号・質量数・原子番号
例 $\LARGE{_{11}^{23}\text{Na}}$
Naを元素記号といい,ナトリウムを表す。左上の23は質量数を表す。
質量数=陽子の数+中性子の数
左下の11は原子番号を表す。原子番号は陽子の数に等しい。
よって,ナトリウムの陽子の数は11,中性子の数は23ー11=12,電子の数は11である。
同位体(アイソトープ) 多くの元素は中性子の数の違いにより,質量数の異なる同位体をもつ。同位体の中には放射線を出しながらほかの原子に変わる放射性同位体がある。放射線を出す性質を放射能という。
水素の同位体 $^1\text{H}$(水素),$^2\text{H}$(重水素),$^3\text{H}$(三重水素)
三重水素は放射性同位体であり,天然にはほとんど存在しない。
炭素の同位体 $^{12}\text{C}$,$^{13}\text{C}$,$^{14}\text{C}$
たとえば,$^{13}\text{C}$は炭素の同位体であり,原子番号は6だから,陽子の数は6である。また,中性子の数は13-6=7である。
また,$^{14}\text{C}$ は放射性同位体であり,遺跡発掘の際の現代測定に用いられている。放射性同位体が元の量の半分になる時間を半減期という。
原子と元素の違い
原子は粒子を指し,元素は種類を指す。たとえば,「自然界にはさまざまな元素が存在し,原子は陽子・中性子・電子によって構成される」のように使い分ける。
電子配置
電子殻 電子の存在できる空間はいくつかの層に分かれ,これらを電子殻という。
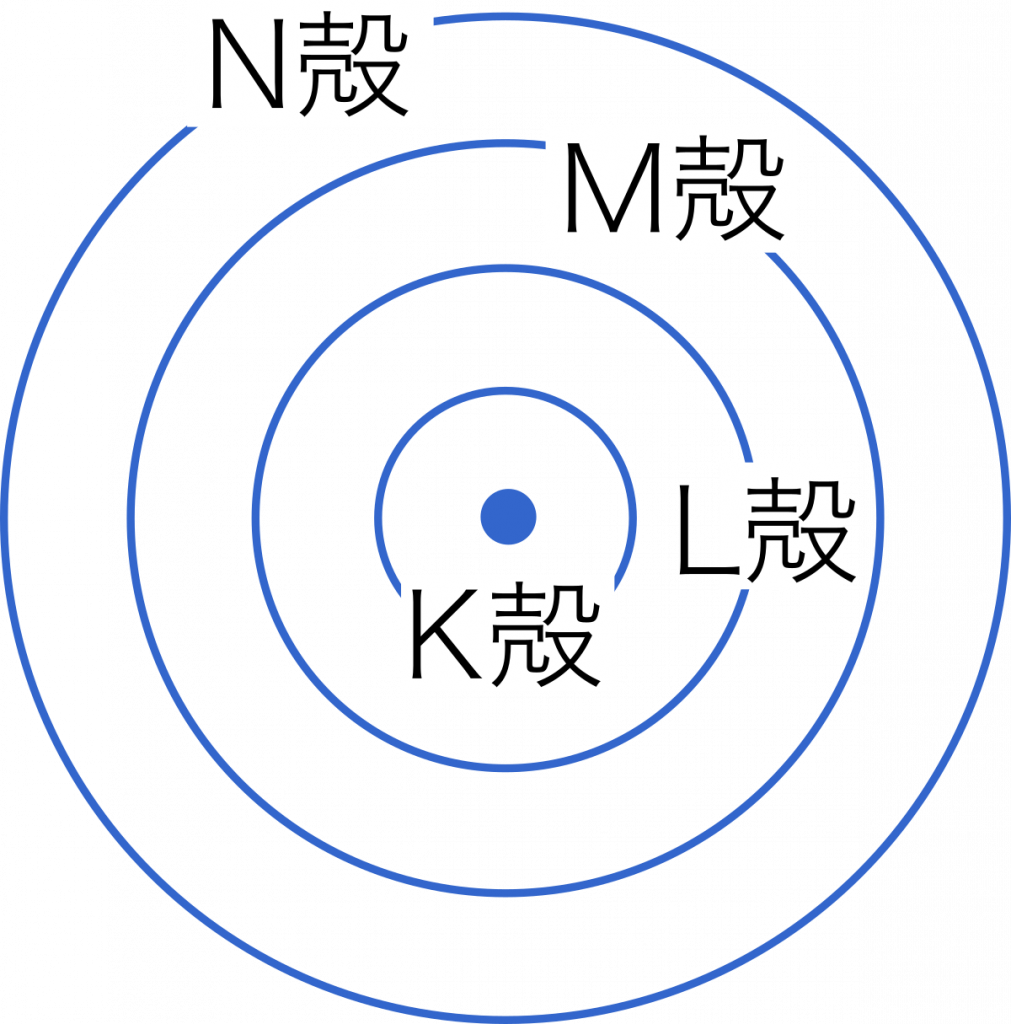
電子の最大数 $2n^2$ 個で表される。
K殻-2個,L殻-8個,M殻―18個,N殻-32個
最外殻電子 原子のもっとも外側の電子殻にある電子。最外殻電子の数は最大で8個。
価電子 最外殻電子の数が1~7個のとき,価電子の数は最外殻電子の数と等しい。また,価電子は原子がイオンになったり他の原子と結合するときに重要な役割を果たす。ただし,希ガスの場合,最外殻電子の数は8個だが,価電子の数は0個として数える。
希ガス 最外殻電子の数が8個のとき,その電子配置は安定となり,他の原子と結びつきにくくなる(ヘリウムの場合は2個)。
希ガスは周期表の一番右側の列に存在している。
ヘリウム He ネオン Ne アルゴン Ar クリプトン Kr キセノン Xe ラドン Rn
閉殻 最大数の電子が収容された電子殻を閉殻という。
周期表
周期律 元素の性質が原子番号に対して周期的に変化することを周期律という。
周期表 周期表の横の行を周期といい,縦の列を族という。H以外の1族元素をアルカリ金属,Be,Mg以外の2族元素をアルカリ土類金属,17族元素をハロゲン,18族元素を希ガスという。また,1,2族,12~18族元素を典型元素,3~11族元素を遷移元素という。
アルカリ金属 リチウムLi ナトリウムNa カリウムK ルビジウムRb セシウムCs フランシウムFr
アルカリ土類金属 カルシウムCa ストロンチウムSr バリウムBa ラジウムRa
ハロゲン フッ素F 塩素Cl 臭素Br ヨウ素I アスタチンAt
金属元素と非金属元素 元素は金属元素と非金属元素に分かれ,非金属元素は周期表の主に右上に存在する。
陽性 原子が陽イオンになりやすい性質を陽性という。周期表では原子が左下にあるほど陽性や強い。そのため,アルカリ金属は陽性が強い。
陰性 原子が陰イオンになりやすい性質を陰性という。周期表では原子が右上にあるほど陰性が強い。そのため,ハロゲンは陰性が強い。
SNSでシェア