【高校化学基礎】化学電池の仕組み

鉛蓄電池習ったんですけど図を見ても覚えられないです。

化学電池は図も大事だけど流れを理解するのが大事だから。説明していくね。
化学電池

まず化学電池は二種類の異なった金属を使う。最初に紹介するボルタ電池は亜鉛 $\text{Zn}$ と銅 $\text{Cu}$ を使う。二つの金属板の間で電気が流れるのはイオン化傾向が異なるから。逆に同じ金属どうしだと電気は流れない。

何で違う金属なんですか?

金属のイオン化傾向の話でやったけど,金属どうしの力関係があってイオン化傾向の大きい方はイオンになれるけど,もう一方はイオンになれない。これを利用する。
ボルタ電池
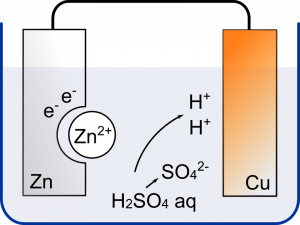

ボルタ電池は亜鉛 $\text{Zn}$ と銅 $\text{Cu}$ を使う。どっちも酸性の水溶液中ではイオンになる,つまり溶けるんだけど,イオン化傾向ってのがあったよね? $\text{Zn}$ > $\text{Cu}$ だから $\text{Zn}$ がイオンになって $\text{Cu}$ はイオンになることができない。

力関係があるんですよね。

そう。$\text{Zn}$ は $\text{Zn}^{2+}$ というイオンとなって水溶液中に溶けていく。

硫酸のあとに書いてある aq って何ですか?

水溶液であることを示す記号。硫酸が水に溶けてるんだな,と理解すればよい。

そして,電子 2 個が放出される。この電子はイオン化傾向の小さいほうに引き寄せられる。つまり $\text{Cu}$ に引っ張られる。
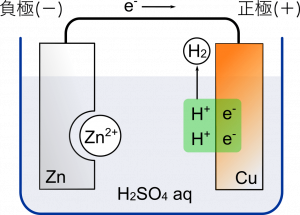

次に $\text{Cu}$ に引き寄せられた電子 $e^-$ は水溶液中の $\text{H}^+$ と結びついて $2\text{H}^+\rightarrow\text{H}_2$ となる。つまり水素分子になるから気体となって水溶液の外に出ていく。

電子は $\text{Zn}$ から $\text{Cu}$ のほうに流れていくから $\text{Zn}$ 側が-,$\text{Cu}$ 側が+になる。

電子は-から+に流れるんでしたね。
ダニエル電池

次にダニエル電池。さっきのボルタ電池って水素が発生するから考えたら危ないよね。

爆発しますね。

そういうわけで水素が発生しない電池が考案された。それがダニエル電池。
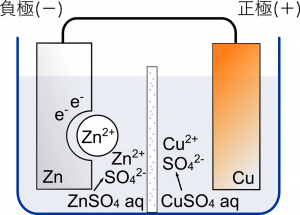

負極に $\text{ZnSO}_4$,正極に $\text{CuSO}_4$ の水溶液を使う。$\text{H}$ が含まれていないから今度は水素は発生しないよね。それぞれイオンになって水溶液の中に溶けている状態。

まん中に板ありますね。

素焼き板っていうのだけど,正極と負極の水溶液が一気に混ざらずにちょっとずつ移動するようになっている。
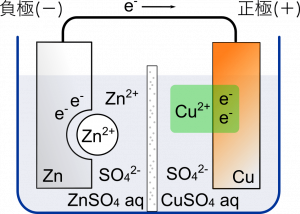

$\text{Zn}$ が溶けだして $\text{Zn}^{2+}$ になる。2 個の電子が放出されたあと導線通って $\text{Cu}$ 側に引き寄せられる。ここはボルタ電池と同じ。

でもダニエル電池のときは電子が $\text{Cu}^{2+}$ と結合する。この $\text{Cu}^{2+}$ は $\text{CuSO}_4$ が電離してできたヤツね。$\text{Cu}^{2+}$ はイオンじゃなくなると固体の銅に戻って析出する。
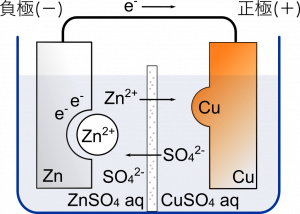

ここで大事なのは $\text{ZnSO}_4$ 水溶液の濃度は薄くすること。イオンはいくらでも溶けるワケじゃなくて,あるところまでいくと飽和水溶液になってそれ以上溶けなくなる。電極の亜鉛がたくさん溶けた方が電気をたくさん作れるのだから薄くする。

$\text{CuSO}_4$ は?

濃くする。$\text{Cu}^{2+}$ は電子を受け取る側だから数が足りないと電気が流れなくなる。$\text{Cu}^{2+}$ はたくさんあったほうがよい。

なるほど。

そうすると素焼き板を入れる意味も分かってくる。左右で水溶液の濃度が違うから分ける必要がある。

でもちょっとずつ混ざるんですよね?

そう,混ざる。実は化学電池がうまく動くためには水溶液の陽イオンと陰イオンの数に偏りがないほうがよい。でも電池の反応が進んでいくとイオンに偏りが生じてしまう。負極側では $\text{Zn}^{2+}$ つまり陽イオンが増えていく。正極側では ${\text{SO}_4}^{2-}$ つまり陰イオンが増えていく。イオンに偏りが生じるの。

そこで素焼き板を通して適度に混ぜる。正極側では-の電荷が強くなってるから負極側の $\text{Zn}^{2+}$ が引き寄せられる。負極側では+の電荷が強くなってるから正極側の ${\text{SO}_4}^{2-}$ が引き寄せられる。こうしてイオンが持つ電荷の偏りが修正される仕組み。

両極の電荷の偏りがなくなるまで移動していく感じですか?

そういうことになるね。そして水溶液中の $\text{Cu}^{2+}$ がなくなると電気が流れなくなる。
鉛蓄電池

鉛蓄電池の説明やるよ。上で紹介したボルタ電池やダニエル電池は実際のところ使われていないのだけど,鉛蓄電池は自動車のバッテリーとして使われている。

また,充電することによってもう一度電池として使うことができる。こういうのを二次電池という。
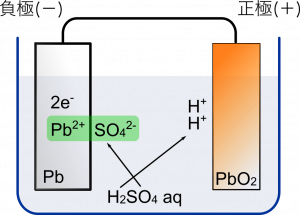

まず登場人物をおさえるところから。負極に鉛 $\text{Pb}$,正極に酸化鉛 $\text{PbO}_2$ を使う。水溶液は $\text{H}_2{\text{SO}}_4$ だからボルタ電池と一緒だよね。これが $2\text{H}^{+}$ と ${\text{SO}_4}^{2-}$ に電離している。

負極の $\text{Pb}$ は ${\text{SO}_4}^{2-}$ と結合して,硫酸鉛(II) $\text{PbSO}_4$ となって析出する。このとき $\text{Pb}$ は $\text{Pb}^{2+}$ の状態になって結合するから電子を 2 個放出する。

この電子が正極側に移動ですね。
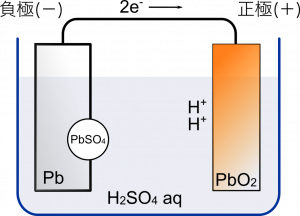

そういうこと。
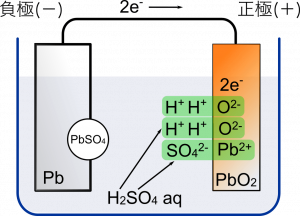

そしてここからボルタのときと話が変わってくる。登場人物として $2\text{H}^{2+}$ と ${\text{SO}_4}^{2-}$ がもう一つ出てくる。つまり $\text{H}^+$ が 4 個,${\text{SO}_4}^{2-}$ が 2 個ある状態。

${\text{SO}_4}^{2-}$ の 1 個は負極で $\text{Pb}$ とくっついたヤツですね。

そうなる。ということは $\text{H}^{+}$ が 4 個,${\text{SO}_4}^{2-}$ が 1 個あることになるね。

そして 正極の $\text{PbO}_2$ は流れてきた電子 2 個を受け取って $\text{Pb}^{2+}$ と $2\text{O}^{2-}$ に分かれる。
$\text{PbO}_2+2\text{e}^-\rightarrow\text{Pb}^{2+}+2\text{O}^{2-}$

さらにそれぞれ $2\text{H}^{+}$,${\text{SO}_4}^{2-}$ と結合する。これで電荷が過不足なく結合するよね。
$\text{Pb}^{2+}+{\text{SO}_4}^{2-}\rightarrow\text{PbSO}_2$
$4\text{H}^{+}+2\text{O}^{2-}\rightarrow2\text{H}_2\text{O}$

+と-の数が合うようにくっつけていけばいいんですね。

最終的に $\text{H}_2\text{O}$ が 2 個,$\text{PbSO}_4$ が 1 個できる。
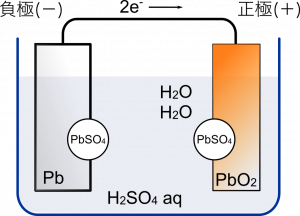

これで鉛蓄電池のできあがり。ボルタ電池やダニエル電池に比べて仕組みがやや複雑だから,発生するイオンと結合するものどうしの組合せをがんばって覚えてね。
SNSでシェア