【高校化学基礎】滴定曲線
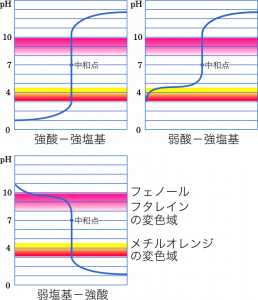

これが滴定曲線。例えば強酸に強塩基を加えていくと中和点の近くで pH が急激に変化する。

何で急に変わるの?

例えば 1 L の水の中に $\text{H}^+$ が 0.1 mol あるとするじゃない。$0.1=1.0\times10^{-1}$ だから水素イオン濃度は $1.0\times10^{-1}$ mol/L で pH 1 になる。ここに $\text{OH}^-$ を 0.01 mol ずつ加えていくと,打ち消し合って $\text{H}^+$ は 0.09,0.08,0.07…と減っていく。そして,$\text{H}^+$ が 0.01 まで減ったところで pH 2 になる。

なりますね。

で,ここにさらに $\text{OH}^-$ を 0.01 mol 加えると,$\text{H}^+$ が全部消えて中性,つまり pH 7 になる。

いきなり増えた。

pH ってこんな感じで中和点近くでは微妙なサジ加減で値が大きく変わる。そういう性質。

ここで覚えておくことをまとめておく。
・フェノールフタレインはアルカリ側で変色。
・メチルオレンジは酸性側で変色。
・強酸に強塩基加えるときはフェノールフタレインでもメチルオレンジでもよい。
・弱酸に強塩基加えるときはフェノールフタレイン。
・弱塩基に強酸加えるときはメチルオレンジ。

覚えた。たぶん。

覚えるときは「メチルオレンジ酸っぱいから酸のほう」って覚えるとよい。

酸っぱいんですか?

毒性あるから触ったらダメ。
滴定曲線の演習
次に示す化合物群のいずれかを用いて調製された 0.01 mol/L 水溶液 A ~ C がある。各水溶液 100 mL ずつを別々のビーカーにとり,指示薬としてフェノールフタレインを加え,0.1 mol/L 塩酸または 0.1 mol/L NaOH 水溶液で中和滴定を試みた。次に指示薬をメチルオレンジに変えて同じ実験をおこなった。それぞれの実験により,下の表1の結果を得た。水溶液 A ~ C に入っていた化合物の組み合わせとして最も適当なものを,下の①~⑧のうちから一つ選べ。(センター2017本試)
化合物群:$\text{NH}_3$ KOH $\text{Ca(OH)}_2$ $\text{CH}_3\text{COOH}$ $\text{HNO}_3$
表1

まず,酸と塩基に仕分け。硝酸 $\text{HNO}_3$ は強酸,酢酸 $\text{CH}_3\text{COOH}$ は弱酸。水酸化カリウム $\text{KOH}$,水酸化カルシウム $\text{Ca(OH)}_2$ は強塩基,アンモニア $\text{NH}_3$ は弱塩基。この辺りは暗記しておくべきこと。

A はメチルオレンジで急激に変化しているから塩基に酸を加えていったことになる。またフェノールフタレインで徐々に変化してる。このページの一番上の表を思い出してほしいけど,このパターンは弱塩基に強酸を加えた場合。選択肢は $\text{KOH}$ か $\text{NH}_3$ だから,弱塩基のアンモニア $\text{NH}_3$ であることが分かる。ここで選択肢⑤~⑧に絞り込む。

結局暗記しろってことか。

B はどちらも色が急激に変化していて,これは強酸に強塩基を加えた場合。

$\text{Ca(OH)}_2$ と $\text{KOH}$ どっちも強塩基ですよ。

そこで物質量を考える。A~C は 0.01 mol/L で 100 mL ある。1 L の 10 分の 1 が 100 mL だから物質量は 0.001 mol ということになる。

そして塩酸と NaOH は 0.1 mol/L で,中和に要した液量が 10 mL だとすると,10 mL は 1 L の 100 分の 1 だから,物質量は 0.001 mol になる。

水溶液が 1 価の塩基なら 10 mL で中和できるけど,2 価の塩基だと $\text{OH}^-$ は 0.002 mol あるはずだから,20 mL で中和できることになる。

$\text{Ca(OH)}_2$ が $\text{OH}^-$ が2個できるヤツですね。

そういうこと。よって選択肢は⑤か⑥。

C を考えると,フェノールフタレインの方で色が急激に変化しているから弱酸に強塩基を加えたパターン。弱酸は酢酸 $\text{CH}_3\text{COOH}$ のほう。

じゃあ,答えは⑤か。

正解。この問題を解くポイントは,強酸と強塩基を暗記してそれ以外の酢酸は弱酸,アンモニアは弱塩基という判断ができること。次に酸・塩基の価数が 1 価か 2 価かの判断ができること。最後に滴定曲線を覚えて色の変化からパターンの見分けができること。

ぼんやりしか覚えてないから全然分からなかった。

そうそう,そんなもの。実際に問題解いてみると結構細かく覚えてないといけないことが分かるよね。頑張って覚えて。
SNSでシェア